Hồ sơ đề xuất cấp giấy phép môi trường nhà máy sản xuất thuốc thú y
Hồ sơ báo cáo đề xuất cấp giấy phép môi trường (GPMT) nhà máy sản xuất thuốc thú y. Sản xuất, san chia thuốc thú y, thuốc thú y thuỷ sản, chế phẩm sinh học, vi sinh vật, hoá chất dùng trong thú y, thú y thuỷ sản: 2.083.800 sản phẩm/năm.
Ngày đăng: 09-09-2025
361 lượt xem
MỤC LỤC
CHƯƠNG I: THÔNG TIN CHUNG VỀ CƠ SỞ.. 7
1.3. Công suất, công nghệ, sản phẩm sản xuất của cơ sở. 10
CHƯƠNG II: SỰ PHÙ HỢP CỦA CƠ SỞ VỚI QUY HOẠCH, KHẢ NĂNG CHỊU TẢI CỦA MÔI TRƯỜNG.. 22
2.2. Sự phù hợp của cơ sở đối với khả năng chịu tải của môi trường. 24
CHƯƠNG III: KẾT QUẢ HOÀN THÀNH CÁC CÔNG TRÌNH, BIỆN PHÁP BẢO VỆ MÔI TRƯỜNG CỦA CƠ SỞ.. 25
3.1. Công trình, biện pháp thoát nước mưa, thu gom và xử lý nước thải 25
3.2. Công trình, biện pháp xử lý bụi, khí thải 32
3.3. Công trình, biện pháp lưu giữ, xử lý chất thải rắn thông thường. 37
3.4. Công trình, biện pháp lưu giữ, xử lý chất thải nguy hại 38
3.5. Công trình, biện pháp giảm thiểu tiếng ồn, độ rung và ô nhiễm khác. 40
3.6. Phương án phòng ngừa, ứng phó sự cố môi trường: 41
3.7. Các công trình biện pháp bảo vệ môi trường khác. 44
CHƯƠNG IV: NỘI DUNG ĐỀ NGHỊ CẤP GIẤY PHÉP MÔI TRƯỜNG.. 44
4.1. Nội dung đề nghị cấp phép đối với nước thải 46
4.3. Nội dung đề nghị cấp phép đối với tiếng ồn và độ rung. 46
4.4. Nội dung đề nghị cấp phép của cơ sở thực hiện dịch vụ xử lý chất thải nguy hại 48
4.6. Nội dung đề nghị cấp phép đối với quản lý chất thải 48
CHƯƠNG V: KẾT QUẢ QUAN TRẮC MÔI TRƯỜNG CỦA CƠ SỞ.. 51
5.1. Kết quả quan trắc môi trường định kỳ đối với nước thải 51
5.2. Kết quả quan trắc môi trường định kỳ đối với khí thải 53
CHƯƠNG VI: CHƯƠNG TRÌNH QUAN TRẮC MÔI TRƯỜNG.. 63
6.1. Kế hoạch vận hành thử nghiệm công trình xử lý chất thải 63
6.2. Chương trình quan trắc chất thải (tự động, liên tục và định kỳ) theo quy định của pháp luật 63
6.3. Kinh phí thực hiện quan trắc môi trường hàng năm.. 64
CHƯƠNG VII: KẾT QUẢ KIỂM TRA, THANH TRA VỀ BẢO VỆ MÔI TRƯỜNG ĐỐI VỚI CƠ SỞ.. 65
CHƯƠNG VIII: CAM KẾT CỦA CHỦ CƠ SỞ.. 66
CHƯƠNG I:
THÔNG TIN CHUNG VỀ CƠ SỞ
1.1. Tên chủ cơ sở
CÔNG TY TNHH KYOTO BIKEN HÀ NỘI LABORATORIES
- Địa chỉ văn phòng:....khu công nghiệp Thăng Long II, xã Nguyễn Văn Linh, tỉnh Hưng Yên, Việt Nam.
- Người đại diện theo pháp luật của chủ cơ sở: Ông ........... Chức vụ: Tổng Giám đốc
- Điện thoại: ..........
- Hộ chiếu số: Hộ chiếu nước ngoài.
- Số giấy tờ pháp lý của cá nhân: ...
- Địa chỉ thường trú : ...
- Địa chỉ liên lạc: ....
- Giấy chứng nhận đăng ký đầu tư mã số dự án..... chứng nhận lần đầu ngày 01/7/2011, chứng nhận thay đổi lần thứ 3 ngày 04/6/2019 do Ban quản lý các khu công nghiệp tỉnh Hưng Yên cấp.
- Giấy chứng nhận đăng ký doanh nghiệp Công ty trách nhiệm hữu hạn hai thành viên trở lên, mã số doanh nghiệp số ... đăng ký lần đầu ngày 01/07/2011 do Sở Kế hoạch và đầu tư tỉnh Hưng Yên cấp. Đăng ký thay đổi lần thứ 5 ngày 28/7/2022.
- Mã số thuế:....
1.2. Tên cơ sở
Thành lập công ty - Xây dựng nhà máy sản xuất thuốc thú y (sau đây gọi tắt là Nhà máy)
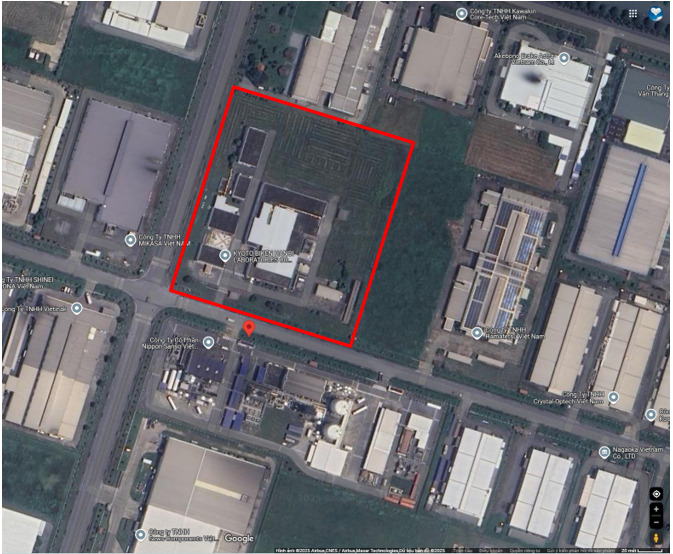
- Địa điểm cơ sở: khu công nghiệp Thăng Long II, xã Nguyễn Văn Linh, tỉnh Hưng Yên, Việt Nam.
- Diện tích Nhà máy là 26.006,1 m2.
Hình 1. Vị trí của cơ sở
1.2.1. Các hồ sơ pháp lý của cơ sở:
+ Giấy chứng nhận đăng ký đầu tư mã số dự án ... chứng nhận lần đầu ngày 01/7/2011, chứng nhận thay đổi lần thứ 3 ngày 04/6/2019 do Ban quản lý các khu công nghiệp tỉnh Hưng Yên cấp.
+ Hợp đồng thuê lại đất gắn với kết cấu hạ tầng số TLIPII – ASL - 21 ngày 22/02/2013 giữa Công ty TNHH KCN Thăng Long II và Công ty TNHH Kyoto Biken Hà Nội Laboratories.
+ Quyết định phê duyệt Báo cáo đánh giá tác động môi trường số 02/QĐ-BQL ngày 03/01/2012 của Ban quản lý các KCN tỉnh Hưng Yên.
+ Sổ đăng ký chủ nguồn thải chất thải nguy hại, mã số QLCTNH: 33.000300T do Sở Tài nguyên và Môi trường tỉnh Hưng Yên cấp ngày 10/12/2013.
+ Giấy phép xây dựng số 03/GPXD ngày 19/01/2012 của Ban quản lý các khu công nghiệp tỉnh Hưng Yên; Giấy phép xây dựng số 22/GPXD ngày 09/10/2013 của Ban quản lý các khu công nghiệp tỉnh Hưng Yên; Giấy phép xây dựng số 16/GPXD ngày 04/5/2016 của Ban quản lý các khu công nghiệp tỉnh Hưng Yên; Giấy phép xây dựng số 27/GPXD ngày 22/8/2016 của Ban quản lý các khu công nghiệp tỉnh Hưng Yên;
1.2.2.Quy mô của cơ sở:
+ Quy mô của dự án đầu tư (theo tiêu chí quy định của pháp luật về đầu tư công): Dự án có tổng mức đầu tư là 609.280.000.000 đồng VNĐ. Căn cứ mục 3. Điều 10 và mục 4 Điều 9 của Luật Đầu Tư Công số 58/2024/QH15 Nhà máy là dự án nhóm B.
+ Quy mô của dự án đầu tư (theo Nghị định 08/2022/NĐ-CP và Nghị định 05/2025/NĐ-CP): cơ sở thuộc mục số II.2 Phụ lục V Nghị định 05/2025/NĐ-CP, Dự án thuộc nhóm III ít có nguy cơ tác động xấu đến môi trường.
2.2.3. Thẩm quyền cấp giấy phép môi trường: Căn cứ theo khoản 3, điều 41 Luật Bảo vệ môi trường Uỷ ban nhân dân tỉnh Hưng Yên là cơ quan có thẩm quyền cấp Giấy phép môi trường cho cơ sở
2.2.4. Yếu tố nhạy cảm về môi trường: Không
2.2.5. Loại hình sản xuất kinh doanh dịch vụ: Sản xuất thuốc thú y
1.3. Công suất, công nghệ, sản phẩm sản xuất của cơ sở
1.3.1. Công suất hoạt động của cơ sở
Sản xuất, san chia thuốc thú y, thuốc thú y thuỷ sản, chế phẩm sinh học, vi sinh vật, hoá chất dùng trong thú y, thú y thuỷ sản: 2.083.800 sản phẩm/năm.
1.3.2. Công nghệ sản xuất của cơ sở
Sản phẩm chế phẩm sinh học, thuốc thú y tuy gồm nhiều loại khác nhau nhưng trình tự sản xuất các loại sản phẩm tương tự nhau, chỉ khác nhau về thành phần, vi sinh vật sử dụng, môi trường nuôi cấy… Các sản phẩm chế phẩm sinh học thực chất là một nửa quy trình sản xuất thuốc thú y. Từ các chế phẩm sinh học thêm một số công đoạn pha chế, san chia chai sẽ tạo sản phẩm là thuốc thú y (đối với dự án là vắc xin phòng bệnh).
Nhà máy không sản xuất đồng loạt các sản phẩm mà sản xuất từng loại tuỳ theo yêu cầu tại từng thời điểm khác nhau. Sau khi sản xuất xong một loại sản phẩm, chuyển qua loại sản phẩm khác thì toàn bộ các thiết bị tiếp xúc trực tiếp với các chất trong quy trình sản xuất đều được tiệt trùng để đảm bảo chất lượng sản phẩm. Do vậy sản xuất chế phẩm sinh học, thuốc thú y đều sử dụng chung một dây chuyền sản xuất gồm các công đoạn khác nhau.
Một số quy trình sản xuất chính của nhà máy bao gồm:
- Sản xuất chế phẩm sinh học
- San chia và sản xuất thuốc thú y
- Sản xuất hoá chất dùng trong thú y (thuốc tiêm)
1.3.2.1. Quy trình sản xuất chế phẩm sinh học
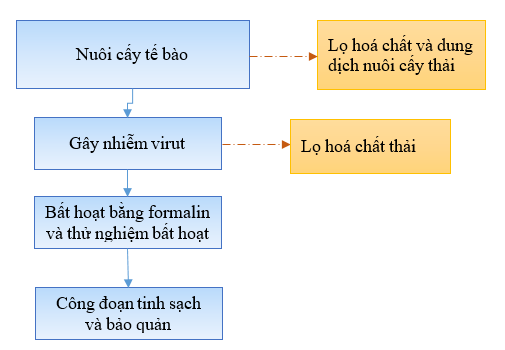
a) Quy trình sản xuất chế phẩm sinh học có bản chất là virus bị bất hoạt
Hình 2. Quy trình sản xuất chế phẩm sinh học có bản chất là virus bất hoạt
* Thuyết minh quy trình:
Công đoạn: Nuôi cấy tế bào:
- Tạo môi trường dung dịch nuôi cấy tế bào gồm các thành phần: Eg MEM 1.861,2 g; FBS 3L; Sodium Bicarbonate 7% 320g; Kháng sinh 20 MU; Nước WFI 168,14L.
- Lựa chọn tế bào vật chủ ứng với mỗi loại virus. Mỗi loại sản phẩm tương ứng với một loại vi rút và tương ứng với một loại tế bào vật chủ khác nhau.
Công đoạn gây nhiễm vi rút:
Tạo môi trường dung dịch nuôi cấy virus với thành phần: Eagle MEM 1.870,6g; Sodium Bicarbonate 7% 288g; Kháng sinh 140MU; Nước WFI 169,4L.
Công đoạn Bất hoạt vi rút bằng Formalin: Cho Formalin có nồng độ cuối cùng là 0,2 vol% vào dịch virus cô đặc rồi để hỗn dịch đó tiếp xúc với nhau ở 28oC trong 7 ngày. Sau thời gian tiếp xúc với formalin thì virus sẽ bị chết hoặc giảm độc lực (khả năng gây bệnh yếu hoặc không còn khả năng gây bệnh khi đưa vào cơ thể). Dịch virus bất hoạt được đem đi thử nghiệm trước khi chuyển sang công đoạn ly tâm.
- Thử nghiệm dịch virus bất hoạt: Dùng dịch thử nghiệm (Nguyên liệu thử nghiệm): Thấm tách 5 ml mẫu thử nghiệm ở 4 độ C trong 24 giờ sử dụng PBS với số lượng gấp 100 lần. Sau khi thấm tách loại bỏ chất bất hoạt để tạo ra dung dịch thử nghiệm (Nguyên liệu thử nghiệm).
+ Tế bào nuôi cấy: Nuôi cấy tĩnh từ 1 ~ 3 ngày tế bào nuôi cấy nổi gốc bằng dung dịch nuôi cấy dùng để tăng trưởng tế bào 2 trong chai nuôi cấy sau đó sẽ tạo ra tế bào nuôi cấy.
+ Trình tự thử nghiệm: Gây nhiễm toàn bộ dung dịch thử nghiệm vào tế bào nuôi cấy theo tỷ lệ 3 cm² / 1 ml, để hỗn dịch đó tự hấp phụ tĩnh ở nhiệt độ 37°C trong 60 phút rồi loại bỏ dung dịch thử nghiệm và bổ sung thêm dịch nuôi cấy tăng trưởng Virus-2, Cuối cùng nuôi cấy ở 37°C trong 7 ngày và quan sát.
- Thử nghiệm vô trùng: Sử dụng phương pháp thử nghiệm vô trùng – Phương pháp thử nghiệm thông thường. iêu chuẩn chế phẩm sinh học dùng cho thử nghiệm để tiến hành thử nghiệm.
Công đoạn tinh sạch
- Ly tâm dịch virus đã bất hoạt bằng máy ly tâm liên tục với tốc độ phù hợp. Lọc lấy dịch nổi bằng lọc.
- Dịch virus tinh sạch được đem đi thử nghiệm trước khi chuyển sang công đoạn bảo quản.
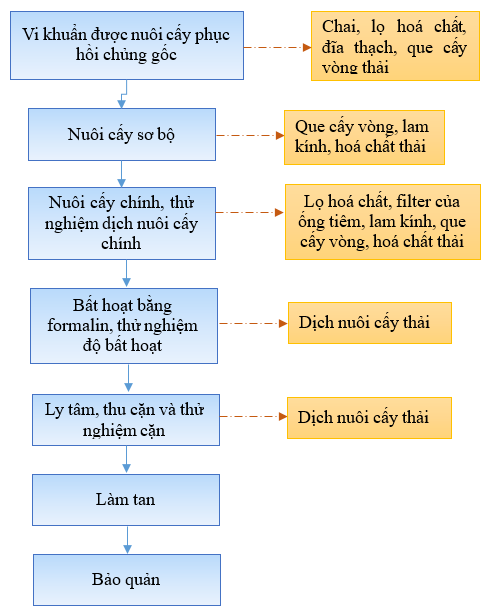
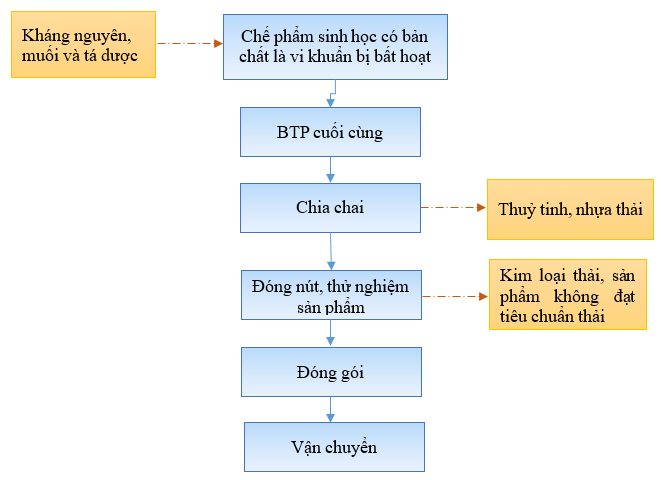
b) Quy trình sản xuất chế phẩm sinh học có bản chất là vi khuẩn bị bất hoạt
Hình 3. Quy trình sản xuất chế phẩm sinh học có bản chất là vi khuẩn bất hoạt
* Thuyết minh quy trình:
Nuôi cấy phục hồi chủng gốc:
+ Sản xuất S broth: Polypepton S 125 g; NaCl 125 g; Yeast Extract (YE) 125 g; Casamino Acid 125 g; Dung dịch Chicken Meat Extract (CME) 1250 ml; 1N NaOH 94 ml; Nước R.O 23.110 ml.
+ Pha chế môi trường Agar: Sbroth 2500 ml; Bacto-Agar 37,5 g; Huyết thanh 250 ml; 1% thiamine monophosphate chloride (TMP) 2,5 ml; Thiamine monophosphate chloride 2,5 g; Nước R.O 250 ml.
+ Các chủng vi khuẩn dùng cho sản xuất được cấy vào các đĩa thạch Agar và được nuôi trong tủ ấp CO₂ ở 37°C.
Công đoạn: Nuôi cấy sơ bộ
+ Sản xuất môi trường nuôi cấy dạng dung dịch: Dung dịch CME 625 ml; Casamino Acid 62,5 g; Polypepton S 62,5 g; YE 62,5 g; NaCl 62,5 g; 1N NaOH 47 ml; Nước R.O 11.578 ml.
+ Hòa tan khuẩn gốc vào 4 ml nước tiệt trùng tinh khiết rồi gây nhiễm 0.05 ml ~ 0.1 ml hỗn dịch đó trong 10 ml môi trường dung dịch sản xuất để chúng tự tăng trưởng trong 24 tiếng với điều kiện nhiệt độ là 37°C, sau đó làm đục hỗn dịch đó lên sẽ tạo ra dịch khuẩn nuôi cấy sơ cấp.
Công đoạn: Nuôi cấy chính
+ Sản xuất môi trường dung dịch nuôi cấy chính: Polypepton S 1000 g; YE 1000 g; Casamino Acid 1000 g; Dung dịch CME 10 L; Nước R.O 187 L.
+ Bổ sung thêm dịch khuẩn nuôi cấy sơ cấp với tỉ lệ 0.25 ~ 0.5 vol% vào môi trường dung dịch dùng cho sản xuất. Sau đó khuấy, nuôi cấy 16 ~ 18 tiếng ở 37°C sẽ tạo ra dịch khuẩn nuôi cấy chính. Ta tiến hành thử nghiệm dịch khuẩn nuôi cấy chính:
+ Thử nghiệm phủ nhận sự có mặt của sinh vật ngoại lai: Sử dụng phương pháp thử nghiệm vô trùng của phương pháp thử nghiệm chung trong tiêu chuẩn chế phẩm sinh học dùng cho động vật để tiến hành thử nghiệm và phải cho kết quả là không nhận thấy sự phát triển của vi khuẩn ngoại trừ khuẩn gốc.
+ Thử nghiệm số vi khuẩn sống: Sử dụng môi trường dung dịch dùng cho sản xuất để pha loãng mẫu 10 lần đến giá trị 10⁻⁷, sau đó trộn lần 0.5 ml dung dịch pha loãng 10⁻⁶, 1.0 ml dung dịch pha loãng 10⁻⁷ và 20 ml môi trường Agar dùng cho sản xuất trong đĩa schale có đường kính 9 cm. Lần lượt chia nhỏ hỗn hợp đó vào 2 đĩa, rồi nuôi cấy trong 48 giờ ở nhiệt độ 37°C bằng carbon dioxide. Sau đó đếm số khuẩn Colony đã phát triển. Khi đếm số vi khuẩn sống cần cứ theo số lần pha loãng nguyên liệu thử nghiệm, lượng dung dịch gây nhiễm, số lượng Colony đã phát triển thì số vi khuẩn sống của mẫu phải đạt như sau: trong 1 ml phải có trên 5x108 con vi khuẩn.
Công đoạn Bất hoạt vi khuẩn bằng Formalin (thimerosal tùy thuộc loại vi khuẩn): Bổ sung Formalin (thimerosal đối với các sản phẩm D8V, D9V, D9VII) theo tỉ lệ 0.2 vol% vào dịch khuẩn nuôi cấy chính rồi trộn đồng nhất hỗn dịch đó, sau đó nuôi cấy tĩnh ở nhiệt độ 2 ~ 5°C trong 48 tiếng. Sau thời gian tiếp xúc với formalin (thimerosal), vi khuẩn sẽ bị chết hoặc giảm độc lực (khả năng gây bệnh yếu hoặc không còn khả năng gây bệnh khi đưa vào cơ thể). Sau khi bất hoạt sẽ tạo ra dịch khuẩn bất hoạt.
Dịch bất hoạt được đem đi thử nghiệm bất hoạt: Chia nhỏ lần lượt 20 ml môi trường dung dịch dùng cho sản xuất vào 10 ống thử nghiệm, sau đó gây nhiễm lần lượt 10 ống đó với 0.5 ml mẫu. Rồi nuôi cấy trong 48 giờ ở nhiệt độ 37°C và quan sát không nhận thấy sự phát triển của vi khuẩn là đạt.
Công đoạn Ly tâm và làm tan: Ly tâm ở nhiệt độ thấp để gạt dịch khuẩn bất hoạt và căn cứ theo kết quả thử nghiệm số vi khuẩn sống của dịch khuẩn nuôi cấy chính thì cứ 1 ml sẽ có 1 × 10¹⁰ con vi khuẩn và cặn nổi trong dung dịch Phosphate Buffered Saline (PBS) sẽ tạo ra bán thành phẩm. Bảo quản bán thành phẩm ở nhiệt độ 2 ~ 5°C.
1.3.2.2. Quy trình san chia và sản xuất thuốc thú y
Thuốc thú y mà nhà máy sản xuất là vắc xin phòng bệnh cho gia súc, gia cầm. Các loại vắc xin này sẽ được sản xuất từ các chế phẩm sinh học đã sản xuất tại nhà máy từ 2 quy trình trên (chế phẩm sinh học có bản chất là virus bất hoạt và chế phẩm sinh học có bản chất là vi khuẩn bất hoạt. Các loại vắc xin chỉ khác nhau về thành phần, quy trình sản xuất tương tự nhau:
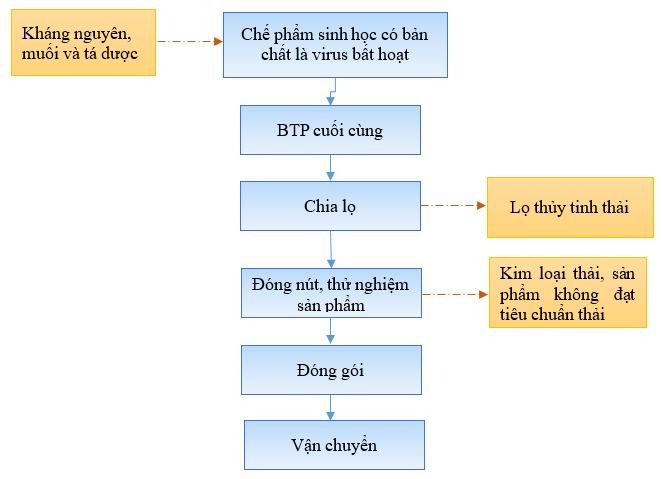
a) Quy trình sản xuất thuốc thú y từ chế phẩm sinh học có bản chất là virus bị bất hoạt
Hình 4. Quy trình sản xuất thuốc thú y từ chế phẩm sinh học có bản chất là virus bất hoạt
* Thuyết minh quy trình:
- Pha chế kháng nguyên, muối, tá dược: Chế phẩm sinh học có bản chất là virus bất hoạt ở quy trình sản xuất. Chế phẩm sinh học được bổ sung thêm Aluminium hydroxide gel (muối) với tỉ lệ 85:15% (1.5 ml), sau đó cho thêm dung dịch Phosphate buffer để pH đạt 6.0 khi đó tạo bán thành phẩm cuối cùng.
- Bán thành phẩm cuối cùng được chia vào từng lọ thủy tinh, nhựa rồi được đậy nút cao su, nắp nhôm và kiểm nghiệm trước khi đóng gói vận chuyển về kho bảo quản chờ xuất hàng.
- Các công đoạn kiểm nghiệm:
+ Thử nghiệm vô trùng: Sử dụng phương pháp thử nghiệm vô trùng – phương pháp thử nghiệm thông thường - Tiêu chuẩn chế phẩm sinh học dùng cho thử nghiệm để tiến hành thử nghiệm.
+ Thử nghiệm sản phẩm chia chai:
Thử nghiệm phủ nhận độc tính bất thường: Sử dụng phương pháp thử nghiệm phủ nhận độc tính bất thường – phương pháp thử nghiệm thông thường - Tiêu chuẩn chế phẩm sinh học dùng cho thử nghiệm để tiến hành thử nghiệm.
Thử nghiệm hiệu giá: Tiêm lần lượt 0.5 ml dung dịch tiêm (sản phẩm thử nghiệm) vào 5 con chuột thử nghiệm, tiêm 2 mũi, mỗi mũi cách nhau 3 tuần. Sau khi tiêm mũi 2, ở ngày thứ 7, tiến hành thử nghiệm chệ ngự ngưng kết hồng cầu đối với huyết thanh của chuột thử nghiệm.
Cho 0.8 ml dung dịch muối sinh lý Caolin 25 w/v% vào 0.2 ml huyết thanh của động vật thử nghiệm đã được bất hoạt sau đó để hỗn dịch đó ở nhiệt độ thường trong 20 phút rồi ly tâm. Bổ sung 1 vol% dịch nổi hồng cầu chuột vào dịch nổi thu được sau khi ly tâm hỗn dịch trên ở 1.700G trong 10 phút, rồi khuấy đều. Tiếp tục để hỗn dịch đó ở nhiệt độ thường trong 20 phút, rồi lại ly tâm 1.700G 10 phút. Thu dịch nổi sẽ tạo ra huyết thanh pha loãng 10 lần.
Thử nghiệm chệ ngự ngưng kết hồng cầu: Tiến hành trong ống nghiệm loại nhỏ. Pha loãng 0.2 ml huyết thanh pha loãng 10 lần bằng khoảng 0.2 ml dung dịch PBS có bổ sung BSA 0.1 w/v%, tiếp theo bổ sung 0.2 ml 4 đơn vị kháng nguyên hồng cầu vào các dung dịch pha loãng rồi để ở nhiệt độ 37°C trong 60 phút. Sau đó lại bổ sung 0.2 ml dịch nổi hồng cầu chuột 1 vol% (nổi lên trong PBS có bổ sung 0.1 w/v% BSA) vào hỗn dịch trên, rồi nuôi cấy tĩnh ở nhiệt độ thường từ 1 ~ 2 giờ và quan sát.
b) Quy trình sản xuất thuốc thú y từ chế phẩm sinh học có bản chất là vi khuẩn
Hình 5. Quy trình sản xuất thuốc thú y từ chế phẩm sinh học có bản chất là vi khuẩn bất hoạt
* Thuyết minh quy trình:
- Chế phẩm sinh học có bản chất là vi khuẩn bất hoạt được bổ sung thêm dung dịch Phosphate buffered saline (PBS), rồi bổ sung 10 vol% các chất ri-sodium phosphate dodecahydrate 16 w/v%, Aluminum chloride hexahydrate 10 w/v% và cô đặc hỗn dịch đó.
Ngoài ra, bổ sung thêm lượng Phenol 0.1 w/v% tồn dư (chất bảo quản), và dùng sodium hydroxide để điều chỉnh giá trị pH đạt 6.6 ~ 7.2, rồi bổ sung lượng Phosphate buffered saline tồn dư để tạo ra bán thành phẩm cuối cùng.
- Bán thành phẩm cuối cùng được chia vào từng lọ thủy tinh, nhựa rồi được đậy lắp cao su và kiểm nghiệm trước khi đóng gói vận chuyển về kho bảo quản chờ xuất hàng.
- Các công đoạn kiểm nghiệm: Thử nghiệm sản phẩm chia chai:
+ Thử nghiệm định lượng formalin (thimerosal đối với các sản phẩm D8V, D9V, D9VII): Sử dụng phương pháp định lượng Formalin (thimerosal) của phương pháp thử nghiệm chung trong tiêu chuẩn chế phẩm sinh học dùng cho động vật để tiến hành thử nghiệm, hàm lượng Formalin (thimerosal) phải dưới 0.05 vol%.
+ Thử nghiệm định lượng Aluminium: Sử dụng phương pháp thử nghiệm định lượng Aluminium của phương pháp thử nghiệm chung trong tiêu chuẩn chế phẩm sinh học dùng cho động vật để tiến hành thử nghiệm, thì kết quả thử nghiệm phải đạt như sau: Trong 1 ml dung dịch thì hàm lượng Aluminium phải nằm trong phạm vi 0.95 ~ 1.30 mg.
+ Thử nghiệm định lượng Phenol: Sử dụng phương pháp định lượng Phenol của phương pháp thử nghiệm chung trong tiêu chuẩn chế phẩm sinh học dùng cho động vật để tiến hành thử nghiệm, hàm lượng Phenol phải dưới 0.1 vol%.
+ Thử nghiệm xác nhận mức độ độc tính: Sử dụng phương pháp thử nghiệm xác nhận mức độ độc tính của phương pháp thử nghiệm chung trong tiêu chuẩn chế phẩm sinh học dùng cho động vật để tiến hành thử nghiệm và kết quả của thử nghiệm phải đạt. Tuy nhiên, lượng tiêm cấy là 0.2 ml và phải tiến hành cân trọng lượng của động vật thử nghiệm ở ngày thứ 4 sau khi tiêm cấy. Pha loãng 10 lần nguyên liệu thử nghiệm trong dung dịch Phosphate buffered saline để tạo ra nguyên liệu tiêm cấy. Động vật thử nghiệm: Sử dụng 08 chuột thử nghiệm có trọng lượng khoảng 300g. Sử dụng kháng nguyên để phản ứng với kháng thể enzym vi khuẩn gốc.
+ Thử nghiệm kiểm tra ngoại quan: Không có dị vật, mùi lạ trong dung dịch đã bị làm đục, có màu vàng nhạt và đặc tính của từng chai đựng dung dịch chia nhỏ phải đồng nhất.
+ Thử nghiệm đo pH: Sử dụng máy đo pH để đo pH của sản phẩm. Sản phẩm đạt yêu cầu phải có pH đạt từ 6.6 – 7.2.
Sau khi sản phẩm đã đạt được các tiêu chuẩn đề ra trong quá trình thử nghiệm, được đem đi đóng gói sản phẩm chia chai vào hộp giấy để tạo ra thành phẩm và vận chuyển về kho chờ xuất hàng.
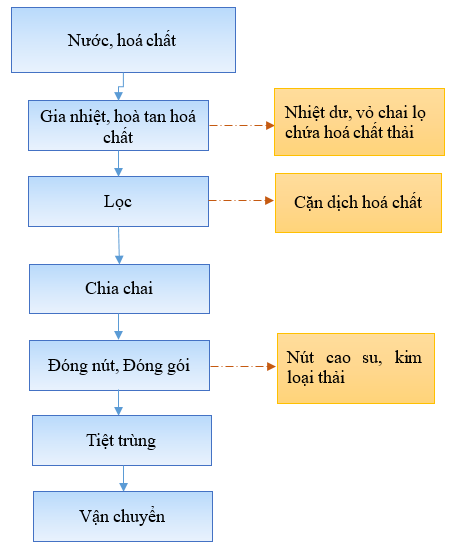
1.3.2.3. Quy trình sản xuất hoá chất (thuốc tiêm) dùng trong thú y
Hoá chất ở đây là thuốc tiêm. Quy trình sản xuất thuốc tiêm như sau:
Hình 6. Quy trình sản xuất thuốc thú y từ chế phẩm sinh học có bản chất là virus bất hoạt
* Thuyết minh quy trình:
Thành phần trong 1 lọ hóa chất dùng trong thú y (20ml), gồm:
+ Sodium chloride: 160.0 mg
+ Potassium dihydrogenphosphate: 9.0 mg
+ Di-Sodium hydrogen phosphate, 12-water: 50.4 mg
+ Đỏ phenol (chất chỉ thị pH): 0.2 mg
+ Nước RO
Hóa chất dùng trong thú y được sản xuất bằng cách: cho 480g Sodium chloride (0.8 w/v%) + 27g Potassium dihydrogenphosphate (0.045 w/v%) + 151.2g Di-sodium hydrogen phosphate, 12-water (0.252 w/v%) + Nước RO rồi bổ sung 0.6g Phenol (1 w/v%) vào bình chứa dung tích 60lit sau đó gia nhiệt, hòa tan ở nhiệt độ 121°C trong 30 phút. Sau đó lọc hỗn hợp dịch bằng màng lọc Membrane (có kích thước lỗ lọc là 450 nm) để thu dung dịch hóa chất.
Cuối cùng dịch hoá chất được chia ra các chai nhỏ 20 ml, rồi đóng nút cao su và tiệt trùng ở 121°C trong 40 phút sẽ tạo ra dung dịch hòa tan vắc xin, sau đó vận chuyển về kho bảo quản chờ ngày xuất hàng.
1.4. Nguyên, nhiên liệu, vật liệu, hóa chất sử dụng của cơ sở; nguồn cung cấp điện, nước của cơ sở
1.4.1. Nguyên, nhiên, vật liệu và hoá chất sử dụng để sản xuất
Do tính chất đặc thù sản xuất phụ thuộc vào đơn hàng của khách hàng vì thế công suất của mỗi loại sản phẩm cũng như nhu cầu nguyên liệu, phụ liệu của dự án sẽ được điều chỉnh theo từng thời điểm yêu cầu sản xuất của khách hàng.
Bảng 1. Nhu cầu nguyên vật liệu hóa chất sản xuất của cơ sở
|
STT |
Tên nguyên liệu, vật tư |
Đơn vị tính |
Số lượng |
|
1 |
Nhôm Photphat |
Gam |
198.767 |
|
2 |
Chất kháng sinh Amphotericin B |
Gam |
15,1 |
|
3 |
Bovine Coronavirus No.66/HL strain, inactived bulk |
Mi-li-lít |
11.889 |
|
4 |
Chất kháng sinh Benzylpenicillin G potassium |
UNIT |
3.601 |
|
5 |
Đường Glucoza. Đóng gói 500g/chai. |
Gam |
1.000 |
|
6 |
Hợp chất muối hữu cơ EDTA |
Gam |
67,4 |
|
7 |
Escherichia coli T-2-KB strain (K99 pili), inactived bulk |
Mi-li-lít |
3.973 |
|
8 |
Huyết thanh bào thai bò (Fetal Bovine Serum) |
Mi-li-lít |
638.552 |
|
9 |
Formalin (Formaldehyde) 37% |
Mi-li-lít |
9.000 |
|
10 |
Chất kháng sinh Kanamycin |
Gam |
260 |
|
11 |
Amino axit glutamic |
Gam |
6.574,2 |
|
12 |
Môi trường nuôi cấy tế bào MEM |
Gam |
211.630,2 |
|
13 |
Natri đihydro phosphate |
Gam |
3.815,4 |
|
14 |
Muối Kali Clorua |
Gam |
560 |
|
15 |
Muối Kali hydro photphat |
Gam |
560 |
|
16 |
Muối Natri Clorua |
Gam |
22.400 |
|
17 |
Muối Natri hydro cacbonat |
Gam |
29.400 |
|
18 |
Sodium Hydrogen L(+) Glutamate Monohydrate |
Gam |
3.000 |
|
19 |
Muối Natri hydro photphat (Disodium Hydrogen Phosphate 12-Water) |
Gam |
8.939 |
|
20 |
Chất kháng sinh Streptomycin |
Gam |
3.600 |
|
21 |
Enzym tách tế bào 1:250 |
Gam |
251,1 |
|
22 |
Enzym tách tế bào T 4799 |
Gam |
112 |
|
23 |
Môi trường nuôi cấy tế bào TPB |
Gam |
66.417 |
|
24 |
YEASTEXTRACT#&Chiết xuất nấm men ( Yeast Extract),CAS: 8013-01-2, đóng gói:500g/lọ. Hàng mới 100% |
Gam |
7.546,3 |
1.4.2. Nguồn cung cấp và nhu cầu sử dụng điện
Nguồn cung cấp điện: Công ty TNHH Khu công nghiệp Thăng Long II
Nhu cầu sử dụng: Theo hoá đơn sử dụng điện thực tế của cơ sở năm 2024 nhu cầu sử dụng điện trung bình khoảng 200.000 KW/tháng.
(Hóa đơn tiền điện hàng tháng tại Nhà máy đính kèm phụ lục)
1.4.3. Nguồn cung cấp và nhu cầu sử dụng nước
Nguồn cung cấp nước: Nước sạch do Công ty TNHH Khu công nghiệp Thăng Long II cung cấp.
Theo hoá đơn sử dụng nước thực tế cơ sở, nhu câu sử dụng nước năm 2024 như sau:
Bảng 3. Nhu cầu sử dụng nước của cơ sở năm 2024
|
Tháng |
Lượng nước sử dụng (m3/tháng) |
Lượng nước sử dụng trung bình (m3/ngđ) |
|
12/2023 |
1.105 |
42,5 |
|
01/2024 |
806 |
31 |
|
02/2024 |
820 |
31,5 |
|
3/2024 |
1.130 |
43,5 |
|
4/2024 |
935 |
36 |
|
5/2024 |
1.104 |
42,5 |
|
6/2024 |
1.174 |
45,2 |
|
7/2024 |
1.460 |
56,2 |
|
8/2024 |
1.387 |
53,3 |
|
9/2024 |
1.927 |
74,1 |
|
10/2024 |
2.175 |
83,7 |
|
11/2024 |
1.104 |
42,5 |
|
Trung bình |
48,5 |
|
|
Ngày sử dụng nhiều nhất |
84 (làm tròn) |
|
(Hóa đơn tiền nước hàng tháng tại cơ sở năm 2024 đính kèm phụ lục)
Hiện nay cơ sở có khoảng 61 công nhân lao động. Công suất hoạt động của nhà máy chỉ đạt khoảng 50% - 70 % so với công suất thiết kế (tùy từng thời điểm). Trường hợp hoạt động 100% công suất thì số lượng công nhân có thể đạt 200 người. Khi nhà máy hoạt động 100% công suất ước tính có khoảng 150 công nhân làm việc và tổng nhu cầu nước cấp cho nhà máy khoảng 100 m3/ngày đêm.
Nhu cầu sử dụng nước cho từng hạng mục của cơ sở như sau:
- Nhu cầu cấp cho 01 người/ngày theo TCVN 13606:2023 là 25 l/người/ngày nên với tối đa 200 người làm việc tại nhà máy, cùng với hệ số không điều hòa giờ = 3 thì tổng lượng nước cấp cho quá trình sinh hoạt của cán bộ công nhân viên là: QSinh hoạt = 150 người x 0,025 x 3 m3/gày = 11,25 m3/ngày đêm.
- Nước vệ sinh phòng nuôi động vật thí nghiệm: khoảng 3,75 m3/ngày đêm.
- Nước cấp cho hoạt động thí nghiệm và sản xuất (nước súc rửa thiết bị thí nghiệm, máy móc sản xuất thuốc): khoảng 50 m3/ngày đêm.
- Nước cấp cho sản xuất thuốc nước: khoảng 30 m3/ngày đêm.
- Nước tưới cây, rửa đường: theo thực tế khoảng 5 m3/ngày đêm.
Tổng hợp nhu cầu sử dụng nước tại nhà máy khi hoạt động tối đa 100% công suất như sau:
Bảng 4. Nhu cầu sử dụng nước cho các hoạt động của nhà máy
|
STT |
Mục đích sử dụng |
Nhu cầu sử dụng nước (m3/ngày đêm) |
Nước thất thoát/bay hơi (m3/ngày đêm) |
Nước thải (m3/ngày đêm) |
|
1 |
Nước sử dụng cho mục đích sinh hoạt của cán bộ công nhân viên |
11,25 |
- |
11,25 |
|
2 |
Nước vệ sinh phòng nuôi động vật thí nghiệm |
3,75 |
- |
3,75 |
|
3 |
Nước cấp cho hoạt động thí nghiệm (pha hoá chất, súc rửa chai lọ hoá chất, máy móc thiết bị sản xuất…) |
50 |
- |
50 |
|
4 |
Nước cấp cho sản xuất thuốc nước |
30 |
Nước đi vào sản phẩm, không xả thải |
|
|
5 |
Nước dùng cho tưới cây rửa đường, … |
5 |
5 |
- |
|
|
Nhu cầu sử dụng nước tổng cộng |
100 |
5 |
65 |
Nước cấp cho PCCC dự kiến khoảng 10 m3/lần: Nước cấp PCCC chỉ phát sinh khi xảy ra sự cố cháy nổ, vì vậy không đưa lượng nước cấp PCCC vào bảng cân bằng nước.
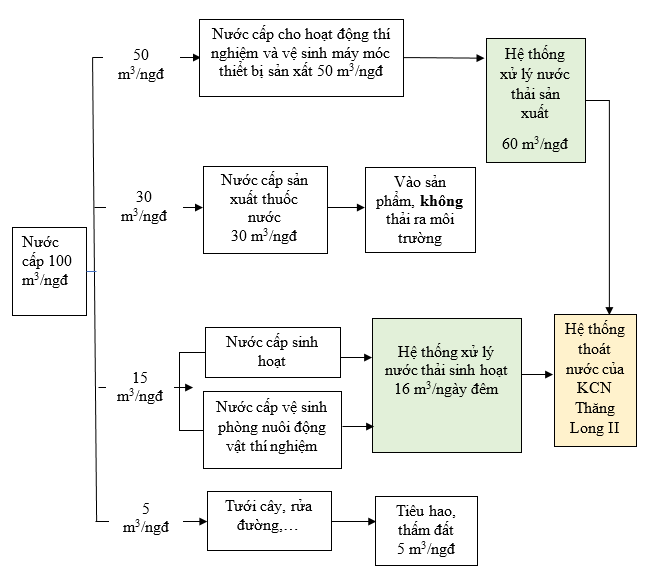
- Sơ đồ toàn bộ quy trình như sau:
Hình 7. Chu trình cân bằng nước khi hoạt động tối đa công suất của cơ sở
- Toàn bộ nước thải từ hoạt động vệ sinh phòng nuôi động vật thí nghiệm và nước cấp cho hoạt động sinh hoạt của cán bộ công nhân viên được thu gom về hệ thống xử lý nước thải sinh hoạt công suất 16 m3/ngđ, đạt tiêu chuẩn đấu nối của KCN Thăng Long II trước khi xả ra hệ thống thu gom của KCN.
- Nước thải từ hoạt động thí nghiệm và vệ sinh máy móc thiết bị sản xuất được thu gom về hệ thống xử lý nước thải sản xuất công suất 60 m3/ngđ để xử lý đạt tiêu chuẩn đấu nối của KCN Thăng Long II trước khi xả ra hệ thống thu gom của KCN.
- Nước cấp cho quá trình sản xuất thuốc nước sẽ đi vào sản phẩm, không thải ra ngoài môi trường.
- Nước sạch được sử dụng cho hoạt động tưới cây rửa đường sẽ tiêu hao hoặc ngấm đất, không xả thải ra ngoài môi trường.
- Toàn bộ nước thải sau hệ thống xử lý nước thải sinh hoạt và hệ thống xử lý nước thải sản xuất được thu gom về hố ga cuối trước khi xả thải ra hệ thống thoát nước của KCN Thăng Long II.
>>> XEM THÊM: Thuyết minh dự án trang trại chăn nuôi heo thịt

Tin liên quan
- › Báo cáo đề xuất cấp GPMT nhà máy chế biến tôm xuất khẩu
- › Báo cáo đề xuất cấp GPMT nhà máy sản xuất bao bì nhựa
- › Hồ sơ đề xuất cấp giấy phép môi trường nhà máy sản xuất hạt nhựa
- › Hồ sơ đề xuất cấp giấy phép môi trường nhà máy sản xuất thực phẩm
- › Đề xuất cấp giấy phép môi trường nhà máy chế biến và kinh doanh lương thực
- › Báo cáo đề xuất GPMT cơ sở sản xuất - gia công thuốc bảo vệ thực vật
- › Báo cáo đề xuất cấp GPMT nhà máy sản xuất chíp thạch anh điện tử
- › Báo cáo đề xuất cấp GPMT nhà máy sản xuất tấm tế bào quang điện và pin năng lượng mặt trời
- › Báo cáo đề xuất cấp giấy phép môi trường nhà máy sản xuất, cắt hạt nha đam
- › Báo cáo đề xuất cấp giấy phép môi trườn nhà máy sản xuất giấy






















Gửi bình luận của bạn