Báo cáo đề xuất cấp giấy phép môi trường dự án Nhà máy sản xuất thuốc và vắc xin thú y
Báo cáo đề xuất cấp giấy phép môi trường dự án Nhà máy sản xuất thuốc và vắc xin thú y. Nhà máy đi vào hoạt động với công suất thiết kế 1.200 tấn sản phẩm/năm.
Ngày đăng: 22-08-2024
797 lượt xem
MỤC LỤC
Chương I. THÔNG TIN CHUNG VỀ DỰ ÁN ĐẦU TƯ.. 2
3. Công suất, công nghệ, sản phẩm sản xuất của dự án đầu tư: 3
3.1. Công suất của dự án đầu tư: 3
3.2. Công nghệ sản xuất của dự án đầu tư: 3
3.3. Sản phẩm của dự án đầu tư: 9
điện năng, hóa chất sử dụng, nguồn cung cấp điện, nước của dự án đầu tư. 10
4.1. Nguyên, nhiên, vật liệu, hóa chất phục vụ dự án. 10
5. Các thông tin khác liên quan đến dự án đầu tư: 14
Chương II. SỰ PHÙ HỢP CỦA DỰ ÁN ĐẦU TƯ VỚI QUY HOẠCH, KHẢ NĂNG CHỊU TẢI CỦA MÔI TRƯỜNG.. 17
2. Sự phù hợp của dự án đầu tư đối với khả năng chịu tải của môi trường. 18
Chương III. KẾT QUẢ HOÀN THÀNH CÁC CÔNG TRÌNH, BIỆN PHÁP BẢO VỆ MÔI TRƯỜNG CỦA DỰ ÁN ĐẦU TƯ.. 19
1. Công trình, biện pháp thoát nước mưa, thu gom và xử lý nước thải: 19
1.1. Thu gom, thoát nước mưa: 19
1.2. Thu gom, thoát nước thải: 22
2. Công trình, biện pháp xử lý bụi, khí thải 50
3. Công trình, biện pháp lưu giữ, xử lý chất thải rắn thông thường: 56
3.1. Công trình, biện pháp lưu giữ chất thải rắn sinh hoạt: 56
3.2. Công trình, biện pháp lưu giữ chất thải rắn công nghiệp: 56
4. Công trình, biện pháp lưu giữ, xử lý chất thải nguy hại: 57
5. Công trình, biện pháp giảm thiểu tiếng ồn, độ rung: 60
5.1. Công trình, biện pháp giảm thiểu tiếng ồn. 60
5.2. Công trình, biện pháp giảm thiểu độ rung. 60
6.1. Biện pháp đảm bảo an toàn, vệ sinh lao động. 60
6.2. Phòng cháy, chữa cháy. 61
6.3. Biện pháp ứng phó sự cố hóa chất 63
6.4. Biện pháp phòng ngừa, ứng phó sự cố khu vực lưu giữ chất thải 63
6.5. Biện pháp, công trình, thiết bị phòng ngừa, ứng phó sự cố hệ thống xử lý nước thải 63
7. Công trình, biện pháp bảo vệ môi trường khác: Không có. 64
Chương IV. NỘI DUNG ĐỀ NGHỊ CẤP GIẤY PHÉP MÔI TRƯỜNG.. 66
1. Nội dung đề nghị cấp phép đối với nước thải: 66
2. Nội dung đề nghị cấp phép đối với khí thải: 66
3. Nội dung đề nghị cấp phép đối với tiếng ồn, độ rung: 67
4. Nội dung đề nghị cấp phép của dự án đầu tư thực hiện dịch vụ xử lý chất thải nguy hại: 68
Chương V. KẾ HOẠCH VẬN HÀNH THỬ NGHIỆM CÔNG TRÌNH XỬ LÝ
CHẤT THẢI VÀ CHƯƠNG TRÌNH QUAN TRẮC MÔI TRƯỜNG CỦA DỰ ÁN.. 71
1. Kế hoạch vận hành thử nghiệm công trình xử lý chất thải của dự án. 71
1.1. Thời gian dự kiến vận hành thử nghiệm: 71
2. Chương trình quan trắc chất thải (tự động, liên tục và định kỳ) theo quy định của pháp luật. 73
2.1. Chương trình quan trắc môi trường định kỳ: 73
2.2. Chương trình quan trắc tự động, liên tục chất thải: 73
2.3. Hoạt động quan trắc môi trường định kỳ, quan trắc môi trường tự động,
liên tục khác theo quy định của pháp luật có liên quan hoặc theo đề xuất của chủ dự án. 73
3. Kinh phí thực hiện quan trắc môi trường hằng năm. 73
Chương VI. CAM KẾT CỦA CHỦ DỰ ÁN ĐẦU TƯ.. 74
MỞ ĐẦU
Dự án “Nhà máy sản xuất thuốc và vắc xin thú y” do Công ty Cổ phần tập đoàn......... được thực hiện tại Xã Trưng Trắc, huyện Văn Lâm, tỉnh Hưng Yên. Dự án đã được Ủy ban nhân dân tỉnh Hưng Yên chấp thuận đầu tư theo Quyết định chấp thuận chủ trương đầu tư đồng thời chấp thuận nhà đầu tư theo Quyết định số 88/QĐ- UBND ngày 22 tháng 10 năm 2021. Đồng thời dự án được UBND tỉnh Hưng Yên phê duyệt báo cáo đánh giá tác động môi trường tại Quyết định số 701/QĐ-UBND ngày 23/03/2022.
Mục tiêu sản xuất của dự án là sản xuất các loại thuốc và vắc xin thú y với tổng mức đầu tư là 230 tỷ đồng. Do đó, theo Khoản 3, Điều 9 Luật Đầu tư công số 39/2019/QH14 ngày 13/06/2019, dự án thuộc dự án nhóm B (phân loại theo tiêu chí quy định của pháp luật về đầu tư công). Quy chiếu theo mục số 02, Phụ lục IV, Nghị định số 08/2022/NĐ-CP, dự án thuộc đối tượng phải có giấy phép môi trường. Công ty Cổ phần tập đoàn Invet tiến hành lập Báo cáo đề xuất cấp giấy phép môi trường cho dự án “Nhà máy sản xuất thuốc và vắc xin thú y” gửi Sở Tài nguyên và Môi trường tỉnh Hưng Yên xém xét, trình UBND tỉnh Hưng Yên phê duyệt.
Dự án chưa thực hiện vận hành thử nghiệm và hoạt động chính thức. Do đó, cấu trúc và nội dung báo cáo đề xuất cấp giấy phép môi trường của Dự án “Nhà máy sản xuất thuốc và vắc xin thú y” được trình bày theo quy định tại Phụ lục VIII ban hành kèm theo Nghị định số 08/2022/NĐ-CP ngày 10/01/2022 của Chính phủ về quy định chi tiết một số điều của Luật Bảo vệ môi trường.
Chương I
THÔNG TIN CHUNG VỀ DỰ ÁN ĐẦU TƯ
1. Tên chủ dự án đầu tư:
Công ty Cổ phần tập đoàn ...
- Địa chỉ văn phòng: ..........., xã Trưng Trắc, huyện Văn Lâm, tỉnh Hưng Yên
- Người đại diện theo pháp luật của chủ dự án đầu tư: .............
- Chức vụ: Giám đốc
- Điện thoại: ...........
- Giấy chứng nhận đăng ký doanh nghiệp: số ......... do Phòng đăng ký kinh doanh thuộc Sở Kế hoạch và Đầu tư tỉnh Hưng Yên cấp lần đầu ngày 07/9/2009, đăng ký thay đổi lần 11 ngày 14/02/2022.
- Giấy chứng nhận đăng ký đầu tư: Công ty Cổ phần Thương mại và Đầu tư ....... được UBND tỉnh Hưng Yên chấp thuận chủ trương đầu tư theo giấy chứng nhận đầu tư số ........ do UBND tỉnh cấp ngày 25/02/2011 chấp thuận cho dự án Nhà máy sản xuất giày vải.
Thông báo số 304/TB-UBND ngày 20 tháng 8 năm 2021 của UBND tỉnh Hưng Yên về việc điều chỉnh dự án “Nhà máy sản xuất giày vải” đổi thành “Nhà máy sản xuất thuốc và vắc xin thú y” trên địa bàn xã Trưng Trắc, huyện Văn Lâm bởi nhà đầu tư Công ty Cổ phần Tập đoàn....
Dự án được UBND tỉnh Hưng Yên chấp thuận đầu tư theo Quyết định chấp thuận chủ trương đầu tư đồng thời chấp thuận nhà đầu tư theo Quyết định số 88/QĐ- UBND ngày 22 tháng 10 năm 2021.
2. Tên dự án đầu tư:
"Nhà máy sản xuất thuốc và vắc xin thú y"
- Địa điểm thực hiện dự án đầu tư: ........., huyện Văn Lâm, tỉnh Hưng Yên.
- Cơ quan thẩm định thiết kế xây dựng: Sở Xây dựng tỉnh Hưng Yên
- Quyết định số 701/QĐ-UBND ngày 23/03/2022 của UBND tỉnh Hưng Yên về việc phê duyệt báo cáo đánh giá tác động môi trường dự án “Nhà máy sản xuất thuốc và vắc xin thú y”;
- Quy mô của dự án đầu tư (phân loại theo tiêu chí quy định của pháp luật về đầu tư công): Dự án nhóm B
3. Công suất, công nghệ, sản phẩm sản xuất của dự án đầu tư:
3.1. Công suất của dự án đầu tư:
Nhà máy sản xuất thuốc và vắc xin thú y đi vào hoạt động với công suất thiết kế 1.200 tấn sản phẩm/năm.
Hiện tại, Công ty có kế hoạch tiến hành sản xuất thuốc bột, thuốc tiêm và thuốc nước. Đối với mục tiêu sản xuất vắc xin, Công ty chưa có kế hoạch sản xuất và hoạt động. Công ty cam kết lập hồ sơ về môi trường theo đúng quy định, trình cơ quan có thẩm quyền phê duyệt trước khi đi vào hoạt động sản xuất sản phẩm vắc xin.
Bảng 1. Quy mô, Công suất của nhà máy
|
STT |
Tên sản phẩm |
Khối lượng |
Ghi chú |
|
1 |
Thuốc bột |
600 tấn sp/năm |
Đang sản xuất sản phẩm mẫu |
|
2 |
Thuốc tiêm, thuốc nước |
450 tấn sp/năm |
|
|
3 |
Vắc xin |
50 triệu liều ~ 150 tấn sp/năm |
Chưa sản xuất |
3.2. Công nghệ sản xuất của dự án đầu tư:
3.2.1. Quy trình sản xuất thuốc bột:
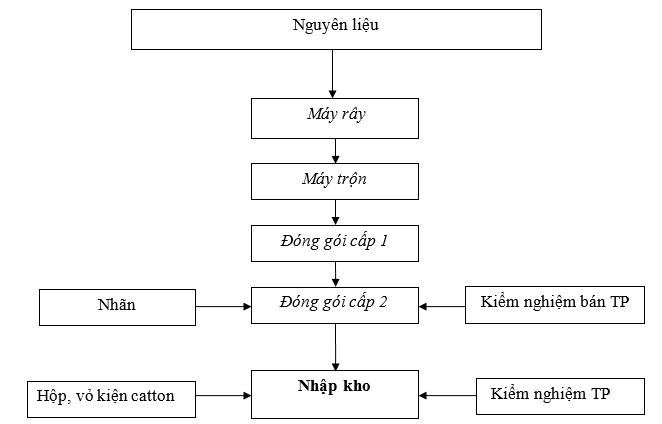
Hình 1. Quy trình sản xuất thuốc bột
Thuyết minh quy trình sản xuất thuốc bột:
- Điều kiện môi trường sản xuất: Độ ẩm < 27oC, nhiệt độ < 75oC
- Rây nguyên liệu:
Quá trình rây nguyên liệu được diễn ra tại máy rây để giúp các tiểu phân có kích thước đối với từng loại sản phẩm và đảm bảo độ đồng nhất của bột.
Đối với mỗi loại thuốc bột khác nhau thì dụng cụ dùng để rây gồm có: Lưới rây, thản rây, đáy rây và nắp rây. Lưới rây được lắp giữa than rây và đáy rây, thuỳ theo đường kính mắt rây hoặc cạnh mắt rây mà có các cỡ rây khác nhau.
Đường đi của tiểu phân càng dài thì khả năng lọt qua lỗ rây càng lớn. Khi rây độ ẩm của bột nên vừa phải để không ảnh hưởng đến khả năng rây.
- Trộn nguyên liệu:
Cho các nguyên liệu sản xuất vào máy trộn theo công thức. Đây nắp, vận hành máy trộn lập phương theo SOP – Quy trình vận hành, vệ sinh, bảo trì với thời gian trộn 30 phút, tốc độ 20 vòng/phút (mức 5).
Kết thúc thời gian trộn, xả vào thùng có lót 2 lớp túi PE, dán nhãn và buộc kín.
Tiến hành lấy mẫu kiểm nghiệm bán thành phẩm thuốc.
IPC kiểm tra cảm quan, độ ẩm thuốc trộn hoàn tất cho phép: ≤ 3,0 % (cài nhiệt độ sấy ẩm 105 oC)
- Giao nhận BTP và bao bì cấp 1:
Tiến hành giao nhận BTP tại phòng biệt trữ chờ ĐGC1 và bao bì cấp 1 sẽ giao nhận tại khu vực nhận bao bì cấp 1.
Khi giao nhận phải có hai người cùng tham gia nhìn cân đảm bảo nguyên liệu đúng số lượng
- Đóng gói cấp 1:
Vận hành máy chiết bột tự động theo SOP quy trình vận hành, vệ sinh, bảo trì với thông số tốc độ chiết ở mức 1
Chiết bột đủ khối lượng theo yêu cầu chuyển vào khay chứa, sau đó sử dụng máy hàn chân để hàn túi trong khay
Vận hành máy hàn chân theo SOP quy trình vận hành, vệ sinh, bảo trì.
Lưu ý : Trường hợp gói không đạt độ kín do có nhiều bột thuốc bám lên mép túi thì phải sử dụng khăn sạch lau lại mép trước khi hàn.
IPC kiểm tra hình thức gói và độ kín theo quy định.
Quy cách :
+ Gói < 100 g, sai số khối lượng không quá ± 5% so với quy cách đóng gói.
+ 100 g ≤ gói ≤ 200 g, sai số khối lượng không quá ± 3% so với quy cách đóng gói.
Độ kín: Gói không bị xẹp khi dùng lực tay ép mạnh lên gói đã hàn trong 1 phút.
Chạy thử kiểm tra độ kín của túi, số lô sản xuất, hạn dùng
Lấy mẫu kiểm tra khi có kết quả đạt yêu cầu thì tiến hành đóng đại trà
Định kỳ 30 phút kiểm tra khối lượng gói thuốc và ghi vào phiếu theo dõi quá trình đóng gói.
- Đóng gói cấp 2 :
Dán nhãn bằng tay, căn nhãn vào chính giữa và cách mép túi đã hàn khoảng 3 cm. Nhãn yêu cầu dán ngay ngắn, không nhăn, rộp, độ lệch giữa mép bên này với mép bên kia cùng cạnh không được quá 2 mm.
Cài đặt và in số lô sản xuất, hạn dùng và ngày sản xuất trên hộp, nhãn thùng. In thử để kiểm tra. Tiến hành in đồng loạt khi đạt yêu cầu.
Vào hộp, đóng kiện: ghi chép thông tin, số lượng.
Đặt phiếu đóng gói vào thùng đã hoàn thành. Ghi tên người thực hiện và kiểm tra.
- Nhập kho: Lấy mẫu lưu mẫu và kiểm tra thành phẩm.
3.2.2. Quy trình sản xuất thuốc tiêm
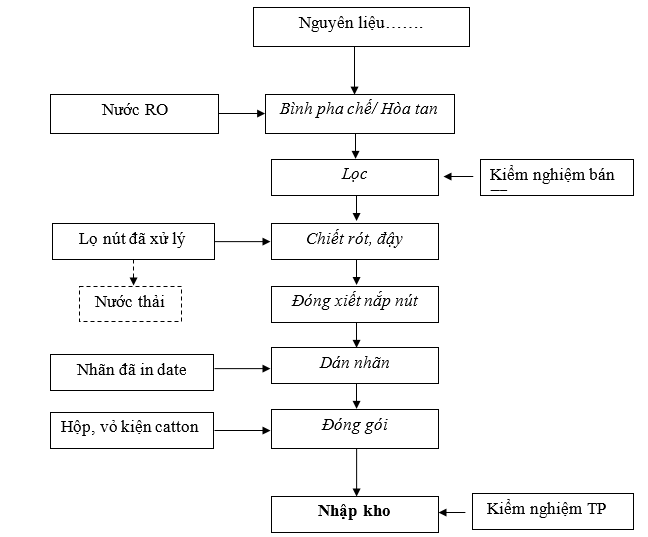
Hình 2. Quy trình sản xuất thuốc tiêm
Thuyết minh quy trình sản xuất thuốc tiêm:
- Tiến hành Pha chế:
+ Cho nước cất vào bồn pha. Vận hành bình pha chế theo SOP hướng dẫn vận hành hệ thống pha chế.
+ Cho toàn bộ lượng nguyên phụ liệu có trong công thức vào bồn pha. Bổ sung nước cất pha tiêm cho đủ thể tích, tiếp tục khuấy trong 5 phút để đồng nhất dung dịch.
+ Lọc: lọc dung dịch qua hệ thống lọc
+ Lấy mẫu kiểm tra BTP (đo PH, định tính, định lượng, soi độ trong)
- Chiết rót và đậy nút cao su
Vận hành máy chiết rót tự động theo SOP quy trình vận hành, vệ sinh với thông số tốc độ chiết ở mức 2 . Chiết dịch đủ thể tích theo yêu cầu .
IPC kiểm tra thể tích, hình thức lọ và độ kín theo quy định. Lấy mẫu kiểm tra khi có kết quả đạt yêu cầu thì tiến hành đóng đại trà.
Định kỳ 30 phút kiểm tra thể tích lọ và ghi vào phiếu theo dõi quá trình chiết rót.
- Đóng gói:
Dán nhãn bằng tay, căn nhãn vào chính giữa và cách mép túi đã hàn khoảng 3 cm. Nhãn yêu cầu dán ngay ngắn, không nhăn, rộp, độ lệch giữa mép bên này với mép bên kia cùng cạnh không được quá 2 mm.
Cài đặt và in số lô sản xuất, hạn dùng và ngày sản xuất trên hộp, nhãn thùng. In thử để kiểm tra. Tiến hành in đồng loạt khi đạt yêu cầu.
Vào hộp, đóng kiện : Số lượng 01 lọ/hộp x 20 hộp/thùng
Đặt phiếu đóng gói vào thùng đã hoàn thành. Ghi tên người thực hiện và kiểm tra.
- Nhập kho : Lấy lưu mẫu và kiểm tra thành phẩm.
3.2.3. Quy trình sản xuất thuốc nước
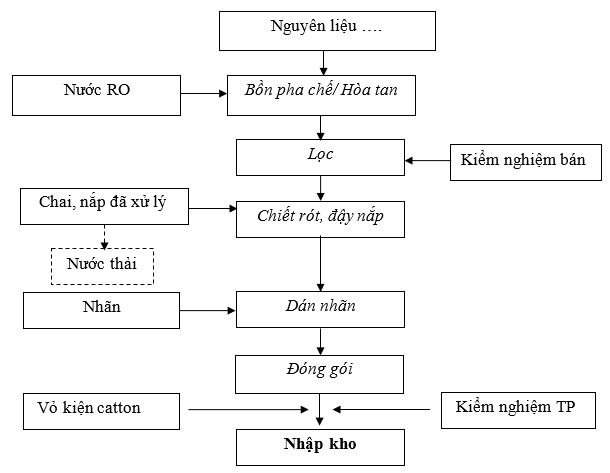
Hình 3. Quy trình sản xuất thuốc nước
Thuyết minh quy trình sản xuất thuốc nước :
- Tiến hành pha chế :
Cho 60 lít nước RO vào bồn pha. Cho Calci có trong công thức vào bồn pha. Khuấy cho đến khi tan hoàn toàn
Bổ sung nước RO cho đủ thể tích 100 lít. Tiếp tục khuấy trong 10 phút để đống nhất dung dịch.
- Chiết rót, đậy nắp :
Chiết dịch vào chai cho đủ 1 lít : Vặn van chiết theo chiều mở khoá, cho dịch thuốc Calci chảy vào chai đo đủ 1 lít. Rồi đậy nắp chai cho kín, nghiêng chai thuốc để kiểm tra độ kín của nắp chai.
- Đóng gói:
Dán nhãn bằng tay, Nhãn yêu cầu dán ngay ngắn, không nhăn, rộp, độ lệch giữa hai mép với cùng cạnh không được quá 2 mm.
Cài đặt và in số lô sản xuất, hạn dùng và ngày sản xuất trên hộp, nhãn thùng. In thử để kiểm tra. Tiến hành in đồng loạt khi đạt yêu cầu.
Vào hộp, đóng kiện : Số lượng 01 chai x 20 chai/thùng
Đặt phiếu đóng gói vào thùng đã hoàn thành. Ghi tên người thực hiện và kiểm tra.
- Nhập kho: Lấy mẫu lưu mẫu và kiểm tra thành phẩm.
3.2.4. Quy trình sản xuất vắc xin
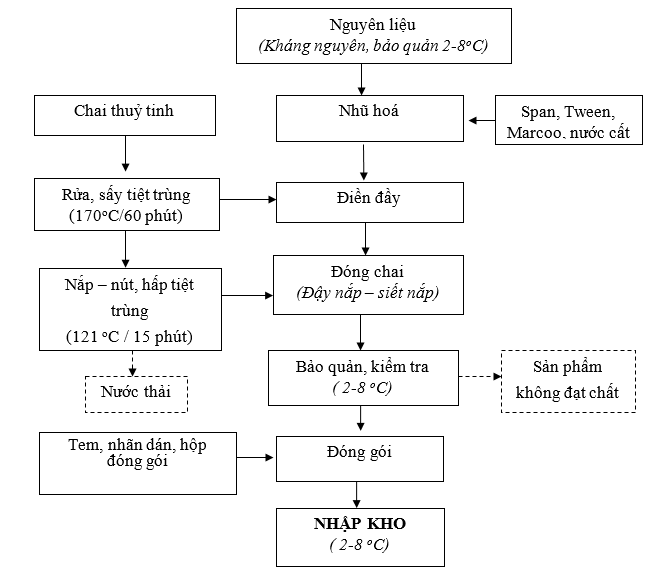
Hình 4. Quy trình sản xuất vắc xin
- Thuyết minh quy trình sản xuất vắc xin:
Kháng nguyên nhập sau khi được lọc, kiểm tra độ vô trùng xong được nhân viên ghi nhãn thông tin kháng nguyên vào bảo quản tạm thời trong phòng lạnh 2-8oC.
- Nhũ hoá:
Tại công đoạn này, kháng nguyên được bổ sung các chất bổ trợ: Span, Tween, Marcol (Pha dầu) được đồng nhất bằng cách sử dụng bể chứa Homogenizer chưa được phân tách, sau đó thêm pha nước vào pha dầu rồi đồng nhất hóa nó (tiền nhũ tương). Sau khi bổ sung các chất phụ trợ xong, kháng nguyên được chuyển vào bể thử, sau đó tiến hành quá trình nhũ hóa với tốc độ 3000 vòng/phút trong 2 giờ. Sau khi nhũ hóa xong, kháng nguyên được chuyển sang công đoạn điền đầy, đóng chai.
- Điền đầy, đóng chai:
Tại công đoạn điền đầy, đóng chai, chai thuỷ tinh nhập về được công nhân chuyển vào máy rửa tự động bằng nước sạch để rửa sạch hết lượng bụi bẩn bám trong và trên thành chai. Sau khi rửa xong, chai nhựa được chuyển đến máy hấp tiệt trùng để tiệt trùng hết vi sinh vật bám trong và trên thành chai. Sau khi rửa và tiệt trùng xong, chai nhựa được chuyển vào máy điền đầy, đóng lắp. Tại đây, vắc xin sẽ được máy điền đầy vào chai sau đó đóng nắp lại theo đúng thiết kế sản phẩm của dự án.
- Bảo quản:
Vắc xin sau khi được đóng chai xong được công nhân bảo quản trong điều kiện phòng lạnh 2-8 oC.
- Kiểm tra và thử nghiệm chất lượng sản phẩm:
Tại công đoạn này, cán bộ công nhân viên công ty sẽ lấy khoảng 02 mẫu vắc xin/lô sản xuất với lượng mẫu lấy khoảng 3 – 5 ml/mẫu để tiến hành kiểm tra độ vô trùng của sản phẩm, kiểm tra hiệu giá kháng nguyên trong phòng thí nghiệm. Sản phẩm sau khi kiểm tra đảm bảo chất lượng sẽ được công nhân chuyển sang công đoạn đóng gói, bảo quản và xuất hàng.
- Đóng gói, bảo quản và xuất hàng
Tại công đoạn này, các chai sản phẩm đảm bảo chất lượng sẽ được công nhân dán tem, nhãn sau đó đóng gói vào bao bì theo đúng thiết kế. Sau khi đóng gói xong, sản phẩm được công nhân vận chuyển về kho chứa bảo quản chờ ngày xuất hàng.
3.3. Sản phẩm của dự án đầu tư:
Các sản phẩm của dự án giai đoạn hiện tại là các loại thuốc thú y:
- Thuốc bột: 600 tấn/năm;
- Thuốc tiêm, thuốc nước: 450 tấn/năm.
- Vắc xin: 50 triệu liều ~ 150 tấn sp/năm (chưa sản xuất)
4. Nguyên liệu, nhiên liệu, vật liệu, phế liệu (loại phế liệu, mã HS, khối lượng phế liệu dự kiến nhập khẩu), điện năng, hóa chất sử dụng, nguồn cung cấp điện, nước của dự án đầu tư
4.1. Nguyên, nhiên, vật liệu, hóa chất phục vụ dự án
Trong quá trình vận hành ổn định giai đoạn hiện tại. Nhu cầu sử dụng nguyên liệu cho sản xuất thuốc bột và thuốc nước, thuốc tiêm thú y của Nhà máy như sau:
Bảng 2. Nguyên, vật liệu, hóa chất chính phục vụ sản xuất
|
TT |
Mã hàng |
Tên hàng |
ĐVT |
Số lượng (kg) |
|
I |
Thuốc bột, thuốc nước, thuốc tiêm |
|||
|
1
|
NL.AMOXAD |
Amoxoxicilline Micronised (Ấn Độ) pha tiêm |
kg |
2,090 |
|
2
|
NL.AMOXTQMIC |
Amoxoxicilline Trihydrate micronized (TQ) |
kg |
2,751 |
|
3
|
NL.ANALGIN |
Analgin |
kg |
1,293 |
|
4
|
NL.BOTDA |
Bột đá ( Canxicacbonat ) |
kg |
28,774 |
|
5
|
NL.CALGLUCO |
Calcium gluconate (pha tiêm) |
kg |
1,377 |
|
6
|
NL.COLISTIN |
Colistin sulphate |
kg |
1,323 |
|
7
|
NL.CON |
Cồn 96 |
Lít |
2,085 |
|
8
|
NL.DOXY |
Doxycycline Hyclate |
kg |
646 |
|
9
|
NL.DTRANG |
Đường trắng DEXTROMONO |
kg |
208,541 |
|
10
|
NL.DUONGKHAN |
Đường khan |
kg |
19,297 |
|
11
|
NL.DUONGLACTOSE100 |
Đường Lactose |
kg |
16,822 |
|
12
|
NL.DUONGVANGCHANH |
Đường vàng chanh |
kg |
5,474 |
|
13
|
NL.ENROBASE |
Enrofloxaxin base |
kg |
550 |
|
14
|
NL.FLOFENICOL |
Florfenicol |
kg |
947 |
|
15
|
NL.GLYCERIN |
Glycerin |
kg |
4,988 |
|
16
|
NL.HSUA |
Hương sữa |
kg |
850 |
|
17
|
NL.HUTAM |
Hút ẩm |
Gói |
14,666 |
|
18
|
NL.LYSIN |
Lysine bột |
kg |
686 |
|
19
|
NL.N-METHYLPROLIDON |
N-Methyl Prolidon |
Lít |
2,973 |
|
20
|
NL.PARA |
Paracetamol nguyên liệu |
kg |
1,795 |
|
21
|
NL.PG |
PG( Propylen Glycon) |
kg |
9,074 |
|
22
|
NL.SAT01 |
Sắt nước (dextran 10%) |
kg |
2,152 |
|
23
|
NL.SORBITOL |
Sorbito |
kg |
1,394 |
|
24
|
NL.SORBITOLLONG |
Sorbitol Solution(lỏng) |
kg |
4,110 |
|
25
|
NL.SULFAMETHOXAZOLE |
Sulfamethoxazole |
kg |
760 |
|
26
|
NL.SULFAMETHOXINE SODIUM |
Sulfamonomethoxine sodium (TQ) |
kg |
496 |
|
27
|
NL.TRIMETHO |
Trimethoprim |
kg |
514 |
|
28
|
NL.VITAMINC |
Vitamin C |
kg |
1,183 |
|
29
|
NL.WHEYNGOT |
Whey ngọt |
kg |
1,392 |
|
II |
Sản xuất vắc xin (chưa sản xuất) |
|||
|
1 |
Span 80 – LQ (dầu nhũ hóa) |
Nguồn gốc: Singapore |
kg |
350 |
|
2 |
Penreco Drakeol 5 |
Nguồn gốc: Singapore |
kg |
450 |
|
3 |
Tween 80 (chất nhũ hóa Polysorbate 80) |
Nguồn gốc: Singapore |
kg |
230 |
|
4 |
Thymerosal (C9H9HgO2S.Na) |
Nguồn gốc: Singapore |
kg |
230 |
|
5 |
Marcoll (dầu khoáng trắng) |
Nguồn gốc: Singapore |
kg |
1460 |
|
6 |
a-Tocopherol (C29H50O2) |
Nguồn gốc: Singapore |
kg |
60 |
|
7 |
Kháng nguyên PCV2 |
Nguồn gốc: Singapore |
kg |
7650 |
|
8 |
Kháng nguyên Myco |
Nguồn gốc: Singapore |
kg |
8500 |
|
9 |
Kháng nguyên FMD |
Nguồn gốc: Singapore |
kg |
6050 |
(Nguồn: Công ty Cổ phần tập đoàn Invet)
Các nguyên liệu đầu vào để sản xuất thuốc thú y đều được nhập khẩu từ nước ngoài, công ty cam kết sẽ thực hiện việc nhập khẩu nguyên liệu theo quy định của pháp luật, cụ thể là khi nhập khẩu nguyên liệu sẽ có hồ sơ xin phép. Hồ sơ nhập khẩu nguyên liệu làm thuốc thú y gồm những tài liệu được quy định tại Khoản 7 Điều 22 Thông tư 13/2016/TT-BNNPTNT quy định về quản lý thuốc thú y do Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn ban hành.
>>> XEM THÊM: Báo cáo đánh giá TĐMT Dự án Hệ thống kênh tưới phục vụ sản xuất nông nghiệp

Tin liên quan
- › Báo cáo đánh giá tác động môi trường của Dự án Nhà máy chế biến thuỷ sản xuất khẩu
- › Báo cáo đề xuất cấp Giấy phép môi trường Nhà máy đan nhựa giả mây và gia công cơ khí
- › Tham vấn ĐTM Dự án Hạ tầng Hạ tầng vùng nuôi trồng thủy sản tập trung
- › Báo cáo đề xuất cấp giấy phép môi trường cơ sở Nhà máy sản xuất nước khoáng
- › Báo cáo đề xuất giấy phép môi trường của dự án Sân golf
- › Báo cáo đề xuất cấp Giấy phép môi trường Dự án Nhà máy dệt kim và may mặc
- › Báo cáo đề xuất cấp giấy phép môi trường Dự án nâng cấp Nhà máy sản xuất bột cá
- › Báo cáo đề xuất cấp giấy phép môi trường Dự án Cảng cạn
- › Báo cáo đề xuất cấp GPMT trang trại chăn nuôi gia cầm quy mô 90.000 con/lứa
- › Báo cáo đề xuất cấp GPMT cho dự án Nhà máy viên nén gỗ xuất khẩu























Gửi bình luận của bạn